sur MEDINCELL (EPA:MEDCL)
Medincell and Teva Submit FDA Application for New Injectable Treatment
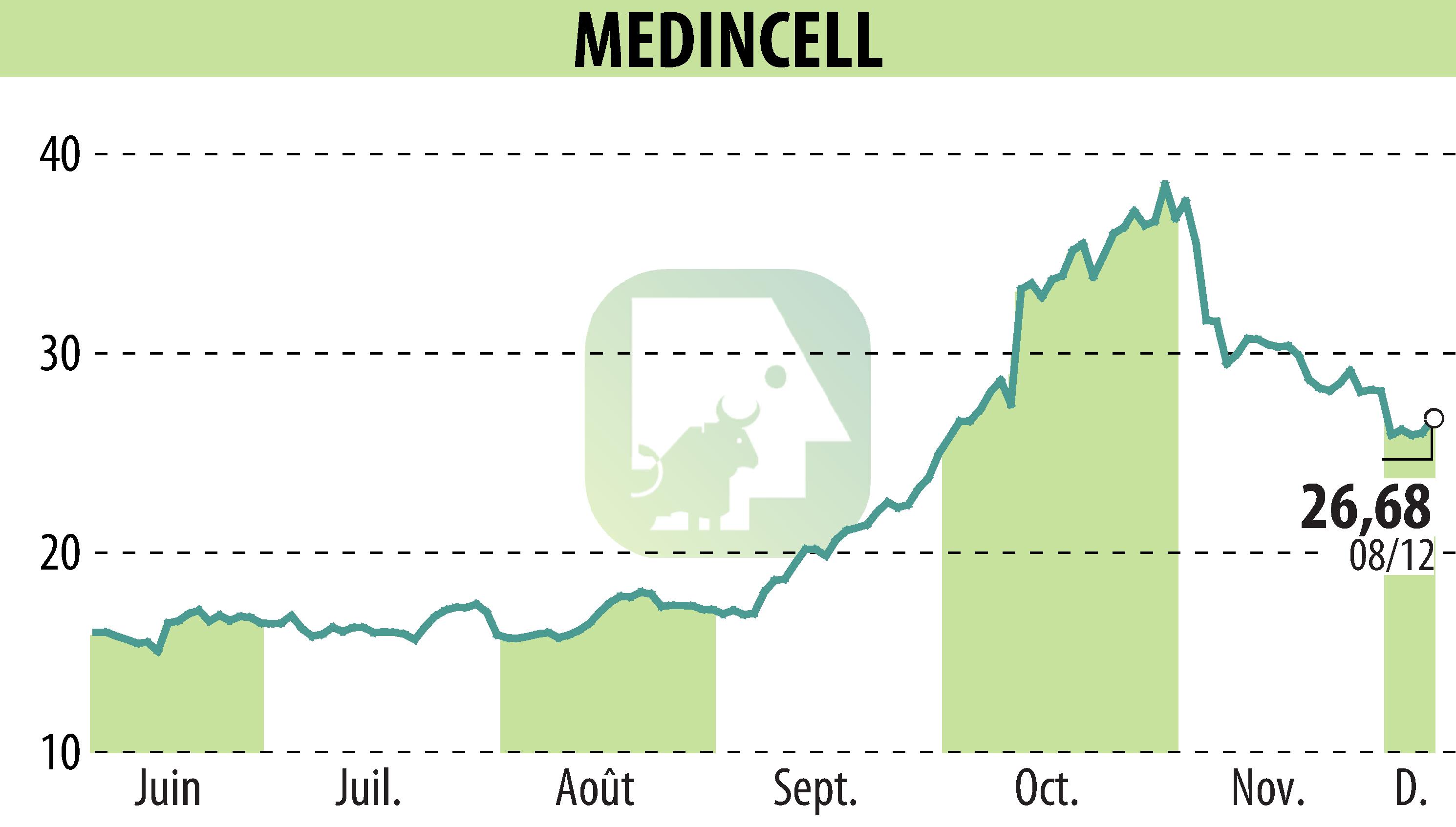
Teva Pharmaceuticals, in partnership with Medincell, has submitted a New Drug Application to the U.S. FDA for olanzapine extended-release injectable suspension (TEV-749/mdc-TJK). This medication is intended for the once-monthly treatment of schizophrenia in adults. The olanzapine long-acting injectable aims to provide efficacy comparable to regular olanzapine, while enhancing patient adherence and stability.
The FDA review typically spans two months for acceptance and a further eight months for a standard review. Olanzapine LAI is designed to bridge a critical treatment gap, addressing adherence issues common in schizophrenia management. Medincell's partnership with Teva is part of their broader strategy to develop long-acting injectables for various therapeutic areas.
R. P.
Copyright © 2026 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de MEDINCELL
