sur ORPHAN SYNERGY EUROPE-PHARMA (EPA:OSE)
FDA Grants Orphan Drug Status to OSE Immunotherapeutics' Pegrizeprument
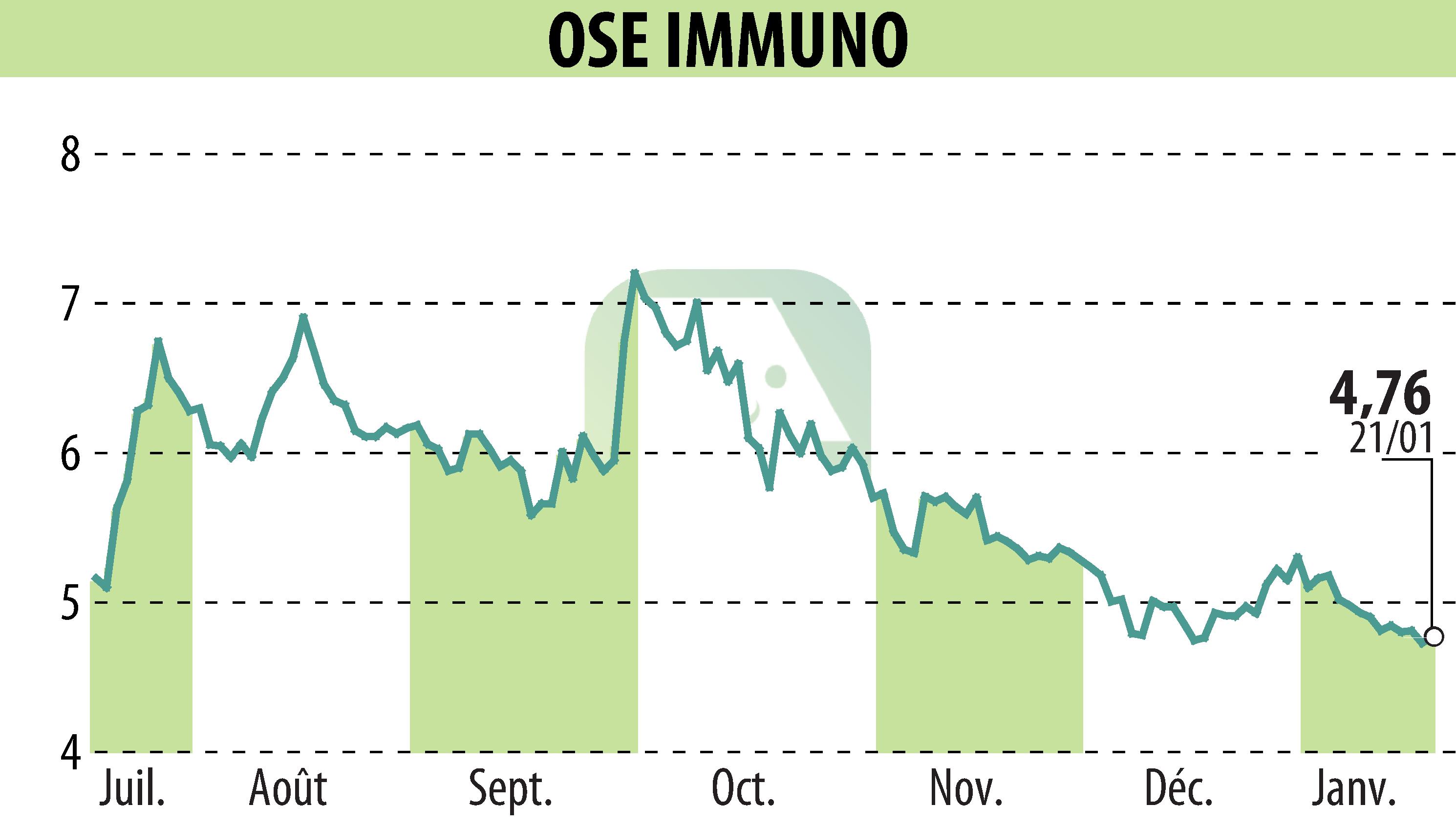
OSE Immunotherapeutics has announced that its partner, Veloxis Pharmaceuticals, has achieved a key regulatory milestone. The U.S. Food and Drug Administration (FDA) has conferred Orphan Drug Designation upon pegrizeprument (VEL-101), intended for preventing organ rejection in liver transplant patients. This antibody fragment, initially developed by OSE, was licensed to Veloxis in 2021. Veloxis will oversee its development and commercialization.
The orphan status highlights a severe need in solid organ transplantation, a point emphasized by OSE's Chief Development Officer, Sonya Montgomery. The designation aims to foster innovative treatments for rare conditions, affecting under 200,000 people in the U.S., by offering incentives to drug developers.
R. H.
Copyright © 2026 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de ORPHAN SYNERGY EUROPE-PHARMA
