sur Protagonist Therapeutics, Inc. (NASDAQ:PTGX)
Un protagoniste soumet une demande d'autorisation de mise sur le marché (NDA) pour l'icotrokinra à la FDA
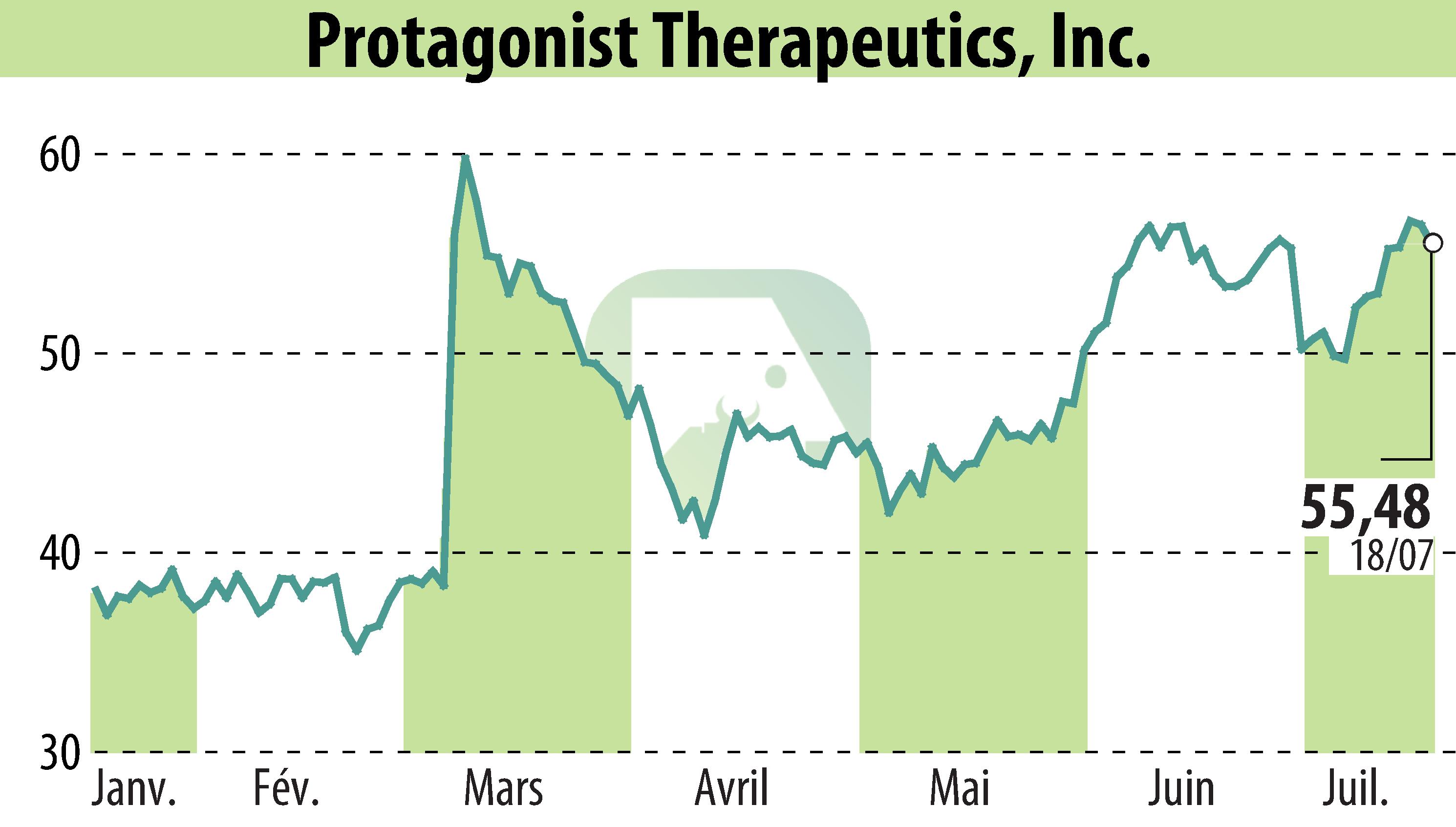
Protagonist Therapeutics a déposé une demande d'autorisation de mise sur le marché (NDA) auprès de la FDA américaine pour l'icotrokinra, un peptide oral expérimental ciblant le récepteur de l'IL-23, développé en collaboration avec Johnson & Johnson. Cette demande vise à obtenir la première autorisation de mise sur le marché (NDA) aux États-Unis pour le traitement du psoriasis en plaques modéré à sévère chez les patients âgés de 12 ans et plus.
La NDA présente les données de quatre études pivots de phase III menées dans le cadre du programme ICONIC. L'icotrokinra a atteint tous les critères d'évaluation principaux, démontrant une amélioration de la qualité de vie et un profil de sécurité favorable. Il s'est avéré supérieur au deucravacitinib lors d'essais comparatifs et a présenté des taux d'événements indésirables similaires à ceux observés avec le placebo.
Ce dossier souligne le potentiel de l'icotrokinra à révolutionner le paysage thérapeutique du psoriasis en offrant une alternative orale efficace et pratique. Protagonist prévoit d'étendre les applications de l'icotrokinra à d'autres pathologies médiées par l'IL-23, telles que le rhumatisme psoriasique et la rectocolite hémorragique.
R. P.
Copyright © 2026 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de Protagonist Therapeutics, Inc.
