sur THERACLION (EPA:ALTHE)
Theraclion soumet le Sonovein à la FDA après une année de succès clés
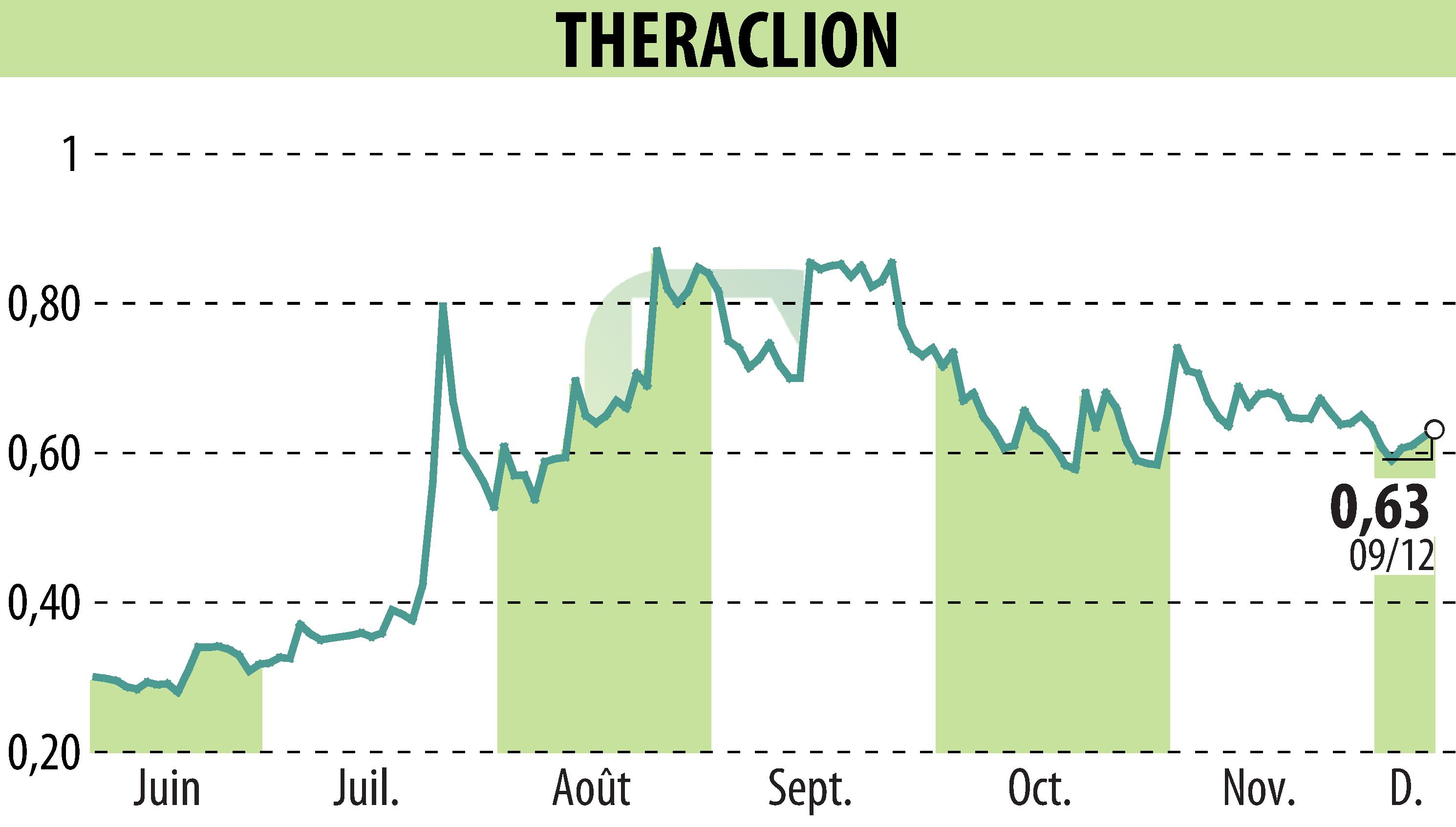
Theraclion, société spécialisée dans les traitements non invasifs des varices, a annoncé le dépôt de sa plateforme Sonovein® auprès de la FDA. Cette étape cruciale marque l'aboutissement d'une année riche en progrès réglementaires et cliniques significatifs. Le dépôt de ce dossier est essentiel à l'obtention de l'autorisation de mise sur le marché (procédure De Novo), ouvrant potentiellement l'accès au vaste marché américain d'ici mi-2026.
Au-delà des États-Unis, Sonovein® a obtenu d'importantes autorisations réglementaires en Europe et en Chine, notamment la certification MDR de l'UE et la conformité aux normes chinoises. Ces progrès renforcent son potentiel de commercialisation future dans ces régions.
L’efficacité de Sonovein® a été renforcée par diverses études cliniques évaluées par des pairs en 2025, avec des résultats impressionnants en matière d’occlusion veineuse et de sécurité des patients. Cette année a également été marquée par une participation active à 16 congrès internationaux, contribuant à accroître sa visibilité auprès des professionnels de santé du monde entier.
R. E.
Copyright © 2026 FinanzWire, tous droits de reproduction et de représentation réservés.
Clause de non responsabilité : bien que puisées aux meilleures sources, les informations et analyses diffusées par FinanzWire sont fournies à titre indicatif et ne constituent en aucune manière une incitation à prendre position sur les marchés financiers.
Cliquez ici pour consulter le communiqué de presse ayant servi de base à la rédaction de cette brève
Voir toutes les actualités de THERACLION
